Frühe Nutzenbewertung - Avatrombopag bei der Immunthrombozytopenie
Die frühe Nutzenbewertung von Avatrombopag (Doptelet®) ist das zweite Verfahren zu einem neuen Arzneimittel in der Therapie der chronischen Immunthrombozytopenie (ITP) im Rahmen des AMNOG-Prozesses. Die Zulassung ist beschränkt auf erwachsene Patient*innen, die auf andere Therapien (Kortikosteroide, Immunglobuline) nicht ansprechen. Das IQWiG wurde mit dem Bericht beauftragt. Die unterschiedlichen Bewertungsvorschläge sind in Tabelle 1 zusammengefasst.
Tabelle 1: Berechnung des Zusatznutzens durch pU und IQWiG
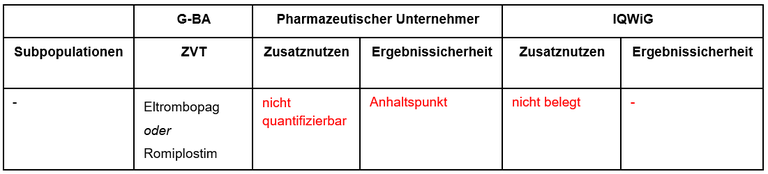
Unsere Anmerkungen sind:
- Die zweckmäßige Vergleichstherapie entspricht den Empfehlungen der Fachgesellschaften.
- Basis der frühen Nutzenbewertung von Avatrombopag ist die Studie 302, eine randomisierte, Placebo-kontrollierte Studien bei Patient*innen mit chronischer ITP nach Vortherapie. 49 Patient*innen wurden in die Studie eingeschlossen.
- Avatrombopag führte im Vergleich zu Placebo zur signifikanten Steigerung der Thrombozytenzahl und zur signifikanten Steigerung der Rate von Patient*innen mit Langzeitansprechen.
- Die Rate schwerer unerwünschter Ereignisse ist niedrig.
- Die Daten zur Lebensqualität sind aufgrund fehlender Werte nicht auswertbar.
Mit Avatrombopag steht jetzt ein weiterer oraler Thrombopoietin-Rezeptor-Agonist zur Therapie der chronischen ITP zur Verfügung. Er kann unabhängig vom Zeitpunkt der Nahrungsaufnahme eingenommen werden. Ein Zusatznutzen gegenüber anderen Thrombopoietin-Rezeptor-Agonisten in Bezug auf die üblichen Patienten-relevanten Endpunkte ist nicht belegt.



